Desarrollo de un antiveneno de nueva generación para tratar accidentes por picadura de alacranes mexicanos
Baltazar Becerril Luján y Lidia Riaño Umbarila
Palabras clave: anticuerpos simplificados, alacranismo, neutralización, genes humanos, biorreactores
Iniciando un grupo con nuevas propuestas para producir anticuerpos
A finales de los años 90 del siglo pasado, en el IBt planeamos e impulsamos nuevas estrategias para obtener anticuerpos usando técnicas de la ingeniería genética, por lo que son llamados recombinantes (propios de un organismo y producidos en otro). Éstos serían de origen humano y producidos en biorreactores o fermentadores usando bacterias o levaduras, y dirigidos contra diferentes antígenos como los componentes tóxicos del veneno de animales ponzoñosos. Nos propusimos en particular, disponer de una amplia colección, o bien ‘repertorio’ o ‘biblioteca’ de fragmentos de anticuerpos de origen humano. En general, los produciríamos y seleccionaríamos como estructuras simplificadas y específicas del anticuerpo, denominadas “fragmento variable de cadena sencilla” o bien, con el acrónimo scFv por single chain fragment variable, que aquí usaremos como apelativo [1].
Anticuerpos simplificados
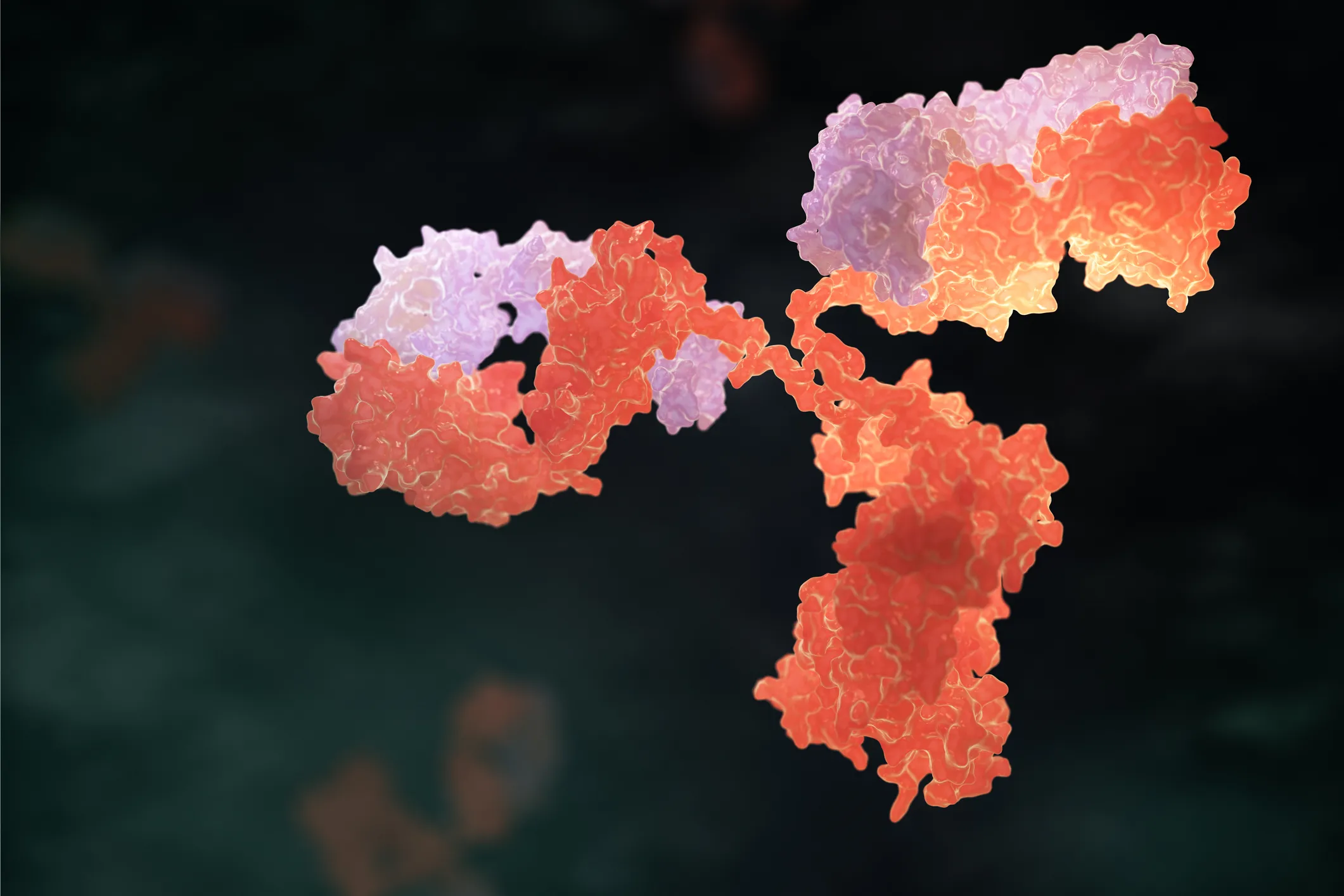
Un anticuerpo es una proteína generada por el sistema inmune de organismos vertebrados, como un mecanismo de protección contra agentes extraños al organismo. Son producidos por los linfocitos B en órganos linfoides como la médula ósea, bazo y timo. El anticuerpo completo tiene forma de Y [Fig. 1] y está constituido por 4 cadenas proteicas (constituidas por unidades moleculares llamadas aminoácidos): dos cadenas pesadas (las de mayor tamaño) y dos cadenas ligeras (las de menor tamaño). Cada cadena tiene a su vez varios ‘dominios’ o segmentos y, si estos se separan aún siguen siendo funcionales; es decir estas proteínas tienen una estructura modular. La cadena ligera posee dos dominios (uno variable y uno constante), mientras que la cadena pesada posee 4 dominios (uno variable y tres constantes). Los dominios variables se llaman así porque sus secuencias son diferentes entre ellas, es decir que cada linfocito produce una secuencia única a nivel de los dominios variables, mientras que las secuencias constantes son las mismas que las producidas por otro linfocito B. Los dominios más interesantes son los dominios variables de los anticuerpos ya que son los encargados de reconocer a las moléculas extrañas al organismo. Con los avances en Biología Molecular es posible manipular la información genética de los anticuerpos para generar nuevas formas estructurales o formatos.
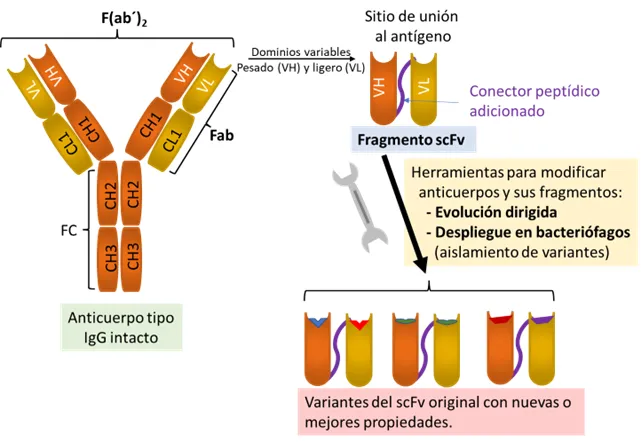
Figura 1. Estrategia general para obtener fragmentos de anticuerpos con fines terapéuticos. La región de reconocimiento al antígeno, de un anticuerpo intacto es la región superior (doble), formada por dominios variables en las cadenas pesadas (VH) y ligera (VL) [Arriba, izq.]. Como partes de una proteína, estos dominios o secciones pueden ser integrados en el formato scFv (fragmento variable de cadena sencilla) y ser modificados (‘madurados’) y producidos por medio de procedimientos específicos de biotecnología moderna. Otros formatos importantes son el Fab conformado por los dominios variables de las cadenas pesada y ligera y las regiones constantes 1 de la cadena pesada y ligera. El formato ‘F(ab´)2’ de los faboterápicos, está constituido por dos fragmentos Fab que permanecen unidos entre sí después de una eliminación selectiva del fragmento constante (Fc). Este último formato es el típico de los antivenenos comerciales.
La forma estructural de ‘anticuerpo mínimo funcional’ es una construcción molecular artificial que corresponde a las regiones que reconocen los antígenos —el dominio variable de las cadenas pesadas (VH) y el correspondiente de las ligeras (VL) de un anticuerpo— que estarían unidos por un péptido conector [Fig. 1]. Entre un mar de posibilidades para obtener anticuerpos que tuvieran un ajuste de interacción preciso con los antígenos, el objetivo sería aislar de estas bibliotecas los genes de anticuerpos neutralizantes de las principales toxinas presentes en los venenos de alacranes ponzoñosos y así, poder producir un antiveneno recombinante.
Técnicas avanzadas para terapias modernas
Para implementar las metodologías necesarias para arrancar estos proyectos, uno de nosotros (Baltazar Becerril), hizo una estancia de investigación en el laboratorio del Dr. James Marks de la Universidad de California en San Francisco (UCSF) en 1997. Allí aprendimos a construir las mencionadas bibliotecas de scFvs de origen humano, en donde encontramos las secuencias que codifican a diversos fragmentos de anticuerpos y de esta manera ‘construir’ un conjunto de múltiples versiones con este formato simplificado de anticuerpo. También aprendimos a ‘desplegar’ (o exponer) los scFv’s en la superficie de un tipo de virus bacteriano, lo cual permite hacer la exploración y selección de anticuerpos específicos [2].
Pero sigamos con la historia: más adelante explicaremos las ventajas y ciertas limitaciones de la metodología que utilizamos (ilustrada en la Figura 2) y de cómo difiere de otras estrategias para obtener antivenenos. Lo que es relevante ahora es que para desarrollar y aprovechar este formato, requeríamos producir versiones reorganizadas (recombinantes y simplificadas), de fragmentos de anticuerpos de origen humano; que tendríamos que mejorar su efectividad a través de inducir una diversificación adicional de las moléculas, para luego tamizarlas o cribarlas a fin de mejorar su capacidad de reconocer y neutralizar venenos; además de poder producirlos por medios biotecnológicos sin utilizar animales domesticados; solo con microorganismos.
Reiniciando en México
Al regresar en 1998, el Dr. Becerril se reintegró como líder académico para conformar nuestro grupo de investigación. Después de varios intentos y con Lidia Riaño como estudiante de doctorado, para el 2002 habíamos logrado construir una biblioteca de scFv’s de origen humano. A partir de ensayos específicos con esta biblioteca, seleccionamos los primeros “fragmentos variables de cadena sencilla” capaces de reconocer a la Cn2 —la toxina principal del veneno del alacrán más mortífero de México, el Centruroides noxius—. Aunque encontramos que este grupo de fragmentos de anticuerpo reconocían a la toxina Cn2 (in vitro), desafortunadamente, no tenían la capacidad de neutralizarla (en ensayos con animales vivos).
¿Cómo madurar los anticuerpos de cadena sencilla?
Para evadir este obstáculo y encausar el objetivo del proyecto, empezamos un trabajo de ingeniería de anticuerpos (una modificación racional, inteligente de los mismos) con el fin de ‘madurar’ —digamos reconvertir/ optimizar los scFv’s humanos seleccionados previamente— mediante dos procesos fundamentales: primero, una mutagénesis dirigida a los mencionados fragmentos variables, que permite generar mayor diversidad en las secuencias involucradas con el reconocimiento y luego, aplicar múltiples rondas de tamizaje para identificar nuevos y mejores scFv’s [Fig. 2]. Para nuestro beneplácito, al final de estos procesos pudimos neutralizar a la toxina Cn2 y, por ser la toxina principal, también al veneno completo de este alacrán [3, 4].
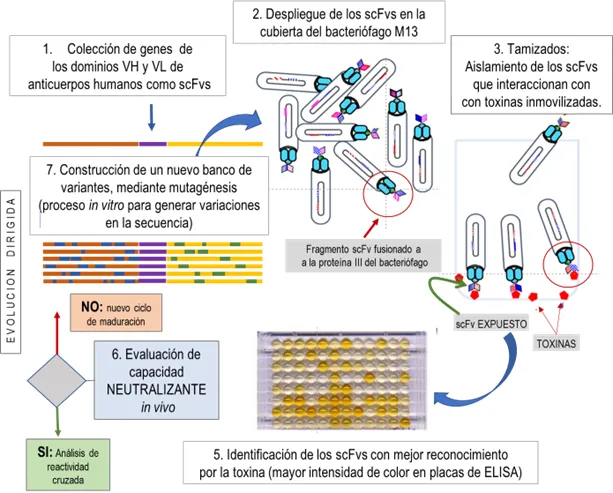
Figura 2. Detalles del proceso de ‘maduración’ de la afinidad para “fragmentos (de anticuerpo) variables de cadena sencilla”. (1.) A partir de la selección previa de scFv’s reactivos, se construye un banco con mutaciones (nuevos fragmentos variantes, 7), que pueden desplegarse como parte de la cubierta de bacteriófagos (2). A partir de esta nueva colección, mediante tamizados es posible aislar aquellas variantes que reconozcan a una toxina particular (3); se continúan las rondas de tamizaje para identificar las mejores variantes. Estos ensayos de inmunodetección se realizan en placas de ELISA (5). Los fragmentos así perfeccionados se someten a evaluación en ratones, para corroborar su capacidad de neutralizar a la toxina contra la que fueron seleccionadas (6). Si aún no presentan un nivel adecuado de neutralización, se inicia un nuevo ciclo de maduración o evolución dirigida (mutagénesis y selección).
El enfoque terapéutico de los investigadores del grupo y también del consorcio sobre venenos y antivenenos, se basa en el fenómeno de que la unión de las toxinas a proteínas transportadoras de iones, provoca una afectación funcional de uno o varios tipos de esos canales iónicos presentes en las células nerviosas [ver art. 32.1 de L. Possani en este número], lo cual resulta en un bloqueo de los impulsos nerviosos y eventualmente, un paro cardiorrespiratorio y la muerte. Los anticuerpos simplificados hasta ahora obtenidos (nuevo antiveneno) en el formato de scFv capturan y neutralizan a las toxinas. En pruebas muy exigentes de neutralización (ratones severamente envenenados), los scFv generados son capaces de rescatar a estos animales en el transcurso de 20-30 minutos posteriores a la inyección de los scFv’s. Nuestro trabajo de muchos años ha sido encontrar y optimizar las mejores alternativas de antivenenos en cuanto a efectividad, seguridad y acceso.
Hacia los antivenenos de nueva generación
Queremos enfatizar que nuestro grupo reportó el primer fragmento de anticuerpo de origen humano, capaz de neutralizar al veneno de un alacrán del que se tenga registro. Mas adelante generamos por evolución dirigida variantes de los primeros scFv humanos y demostramos que permitían neutralizar otras toxinas, así como a sus respectivos venenos completos [5, 6]. Cuando iniciamos esta línea de investigación nos planteamos como meta neutralizar el veneno de las especies tóxicas conocidas en ese momento (7 especies de alacranes mexicanos). A la fecha, el número de especies identificadas como venenosas va en 21 y probablemente sean algunas más.
Antecedentes que justifican y animan nuestra línea de investigación
Y bueno, ¿por qué hacemos todo esto? A nivel mundial, la población mexicana es una de las más afectadas por las picaduras de alacrán (alacranismo) con una media de 300 mil accidentes por año. Los síntomas de envenenamiento son provocados por las toxinas letales de los venenos. Hay varias reacciones fisiológicas notables [ver el art. 32.2 de A. Alagón en este mismo número], aunque todo indica que el efecto local y sistémico de las toxinas en células del sistema nervioso, muscular, digestivo, etc., es debido a trastornos de la función de los canales moleculares (que actúan como poros selectivos en las membranas de las células) y que, en nuestro caso, transportan iones de sodio (Na+).
Se han podido implementar y optimizar las metodologías para cumplir con el objetivo central de la investigación de nuestro grupo. Las metas se enfocan en la generación de un antiveneno recombinante contra la picadura de alacrán en México, el cual estaría constituido por 4-5 fragmentos de anticuerpos recombinantes en formato de cadena sencilla, que sean capaces de neutralizar los venenos de las 21 o más especies de alacranes ponzoñosos de México. Generar un antiveneno de ‘amplio espectro’ es más eficiente, ya que la atención médica debe ser rápida y efectiva, sin necesidad de saber cuál especie de alacrán nos picó.
Pruebas de concepto y pasos cruciales
Como es claro en otras contribuciones de este número, las opciones que se han utilizado para la generación de antivenenos han sido múltiples, con ventajas y desventajas en ‘pruebas de concepto’ (viabilidad funcional); facilidad técnica en su producción, seguridad sanitaria y otras. Aquí comentaremos la importancia de incorporar tecnologías avanzadas para desarrollar un producto que contrarreste algunos de los problemas que han enfrentado las otras opciones, o también las ventajas que se pueden desarrollar con los antivenenos de “fragmentos variables (de anticuerpos) de cadena sencilla”.
Si bien los antivenenos producidos por la hiperinmunización de caballos son eficientes en términos terapéuticos (ver Biotec Mov 32.2 ), éstos siguen siendo una mezcla compleja de anticuerpos que reconocen a todos los componentes de los venenos usados para su producción, lo que pudiera ‘diluir’ su potencia. Además, al provenir de otra especie, tendrían algunos efectos secundarios en humanos. No obstante, han podido ser convertidos a versiones ‘recortadas’ (que son menos inmunógenicas), conservando un buen rendimiento (producción) y una buena afinidad por las toxinas. Sin embargo, una versión más simplificada podría ser aún más eficiente. Pero para avanzar con el desarrollo de los scFv como potenciales agentes terapéuticos, ha sido necesario realizar estudios elaborados de caracterización, para aprobar las diferentes fases clínicas. Algunos ejemplos en este formato desarrollados en otros grupos de investigación ya cuentan con la aprobación de la FDA (agencia federal de los EE. UU., encargada de evaluar y controlar la seguridad en el uso de drogas y alimentos).
Hemos abordado la eficiencia de los antivenenos recombinantes con respecto a su afinidad por las toxinas y que están a niveles sub·nano·molares (alrededor de una décima parte de la mil millonésima parte de la unidad del parámetro de concentración química, llamada mol; 10-10 Molar), mientras que la de los anticuerpos obtenidos por el sistema inmune natural es aproximadamente 10 veces menor, en la escala nanomolar (10-9 Molar). Otro aspecto importante de los anticuerpos simplificados que estamos generando es su inmunoreactividad cruzada (p. ej., un solo tipo de scFv es capaz de reconocer y neutralizar a por lo menos 13 toxinas diferentes). Finalmente, es relevante que los scFvs muestren una buena estabilidad para lograr que tengan una larga duración funcional de su formulación para utilizarse como biomedicamento. Varias de estas propiedades, especialmente la neutralización, han sido mejoradas a través de un proceso iterativo (repetitivo) de mutagénesis, despliegue en fagos de los fragmentos de anticuerpos y de ensayos de neutralización contra las principales toxinas de los venenos, en múltiples rondas de tamizado. Esta optimización ya no depende de la respuesta inmune de ningún modelo animal sino del número de procesos cíclicos de mejoramiento que hagamos.
¿Cómo neutralizar toxinas específicas y también, venenos completos de más especies de alacranes?
Algunos aspectos clave relacionados y que se están abordando en nuestra investigación, son su completa caracterización a nivel molecular, entre otros, por lo que, al determinar y comparar sus capacidades, los nuevos antivenenos se consideran como una alternativa prometedora para que en su momento puedan sustituir a los antivenenos que se usan actualmente (obtenidos mediante la inmunización de caballos y el posterior procesamiento de los anticuerpos). Es por esto que, como parte de la caracterización de venenos realizados en estrecha colaboración con el grupo del Dr. L. Possani, hemos aprendido que, dependiendo de la complejidad de los venenos (número de toxinas clínicamente importantes), uno o más de estos scFv’s han sido capaces de neutralizar el veneno completo. Por ejemplo, con nuestra estrategia hemos optimizado dos ‘unidades’ de scFv’s (nombrados LR y 10FG2), con patentes de invención concedidas [3,4], los cuales, neutralizan a los venenos en ensayos con ratones, de 8 de las 21 especies de alacranes consideradas de importancia médica en México; una de ellas también en los EE. UU. [Fig. 3, Ref. 7 y registro de patente en BiotecMov 25(4): 21-22.

Figura 3. Nombres científicos de los alacranes cuyas toxinas principales (claves internas) han sido neutralizadas con los antivenenos recombinantes generados en nuestro grupo, utilizando bancos de fragmentos de anticuerpos humanos, mutagénesis dirigida, despliegue en fagos y rondas de tamizado.
Otros aspectos destacables de la ‘modernización’ en la generación de antivenenos específicos o genéricos contra picaduras de alacrán en México, es el no tener que depender del empleo de animales (alacranes, caballos o ratones). También es relevante el reducido tamaño molecular del formato scFv comparado con el formato actual de antivenenos —los ‘faboterápicos’ o F(ab’)2 — ya que aquellos representan sólo un 25% de la masa (peso) de estos últimos. Esto significa que, considerando su alta afinidad hacia las toxinas, sería posible aplicar una menor cantidad de proteína en cada dosis del nuevo antiveneno, para lograr una neutralización total de los venenos.
Ahora bien, tomando en cuenta la simplicidad estructural del formato scFv, suponemos que tendrá un carácter inmunogénico mínimo; es decir, un bajo potencial para generar anticuerpos en el paciente picado que inactivaran al antiveneno. Además de que el antiveneno idealmente se aplica una vez en la vida, su efectividad se basa en una distribución más rápida en el cuerpo y una completa eliminación de las toxinas ligadas a los scFv’s por los riñones. Como parte del conjunto de ‘pruebas de concepto’ del proyecto, hemos demostrado esta hipótesis particular, tanto en ratones (seguimiento con marcadores fluorescentes), como en borregos de aproximadamente 50 Kg (rescate del envenenamiento y la detección de los scFvs en la orina), en una reciente colaboración con el Dr. Alejandro Alagón.
Aspectos prácticos respecto de la producción y autorización como biomedicamento
De las validaciones técnicas y académicas, comentaremos ahora otras proyecciones en cuestiones aplicadas, que implican el escalamiento y producción de antivenenos en reactores biológicos (fermentadores o biorreactores). Actualmente estos equipos pueden controlar las variables del proceso de biosíntesis de forma muy precisa, lo cual garantiza lotes del producto muy homogéneos en cuanto cantidad (rendimiento) y calidad (diversidad y estabilidad de sus componentes), derivado de bioprocesos diseñados específicamente (ver art. 32.6 en este número y BiotecMov 21(4):27 ).
Pronto dispondremos de un lote de este formato del antiveneno para implementar los ensayos preclínicos (evaluación intensiva usando animales modelo); los resultados guiarán la forma de continuar los ensayos clínicos (evaluación en humanos) y así, lograr un producto comercial o de interés público o ambos, que pudiera aplicarse y atender rápidamente a los individuos que sean afectados por la picadura de alacranes ponzoñosos. Como proyectos complementarios hemos generado nuevos bancos de scFv’s tanto de origen humano como de ratón, dirigidos contra un grupo de toxinas con secuencias divergentes (diferentes de las ya neutralizadas). Estos nuevos scFv’s, junto con LR y 10FG2, nos permiten neutralizar de manera preliminar un total de 8 venenos de los alacranes que están ilustrados en la Figura 3.
A través de estas estrategias se podría disponer de una formulación del nuevo antiveneno que sea capaz de neutralizar a todos los venenos de los alacranes ponzoñosos de México. Asimismo, consideramos que la experiencia acumulada con esta tecnología en el grupo nos permitirá abordar pronto cualquier proyecto relacionado con el desarrollo de anticuerpos terapéuticos de cualquier fuente —humana o animal, inmunes o no inmunes— con propiedades de afinidad mejoradas con respecto a los presentes en los antivenenos convencionales y probablemente, de los generados por el propio sistema inmune.
Referencias
- Becerril B. y Riaño-Umbarila L. “Quinta generación de antivenenos contra la picadura de Alacrán”. Revista Hypatia No. 25, enero-marzo 2008. Morelos: CCyTEM.
- Becerril B., Riaño L., Possani L. (2014). "Bancos de anticuerpos recombinantes de origen humano: una fuente ideal de antivenenos modernos contra la picadura de alacrán" Revista Digital Universitaria [en línea]. 1 de noviembre de 2014, Vol. 15, No.1. ISSN: 1607-6079. Disponible en: este enlace.
- Becerril B., Rodríguez E., Fernández G., Gómez I., Arredondo J., Riaño L., Possani L., Olamendi T. (2020). “Familia de variantes de anticuerpos recombinantes humanos que neutralizan a los principales venenos de alacranes mexicanos”. Patente Núm. MX/a/2015/011378. Concedida el 10 de noviembre de 2020. Disponible en: este enlace.
- Lidia Riaño Umbarila, Everardo Rodriguez Rodriguez. Baltazar Becerril, Lourival D. Possani. “Familia de variantes de anticuerpos recombinantes que neutralizan a las toxinas de alacrán Cn2 y Css2 asi como a sus respectivos venenos Centruroides noxius y Centruroides suffusus suffusus”. Patente número 325627. Concedida 13 noviembre 2014. Disponible en: este enlace.
- Valencia-Martínez H, T Olamendi-Portugal, R Restano-Cassulini, H Serrano-Posada, F Zamudio, LD Possani, L Riaño-Umbarila & B Becerril (2022). Characterization of four medically important toxins from Centruroides huichol scorpion venom and its neutralization by a single recombinant antibody fragment Toxins 14(6): 369. DOI:10.3390/toxins14060369
- Riaño-Umbarila L, Romero-Moreno JA, Ledezma-Candanoza LM, Olamendi-Portugal T, Possani LD, Becerril B (2021). Full neutralization of Centruroides sculpturatus scorpion venom by combining two human antibody fragments. Toxins 13(10):708. DOI:10.3390/toxins13100708
- Fernández-Taboada G, Riaño-Umbarila L, Olvera Rodríguez A, Gómez-Ramírez I.V, Losoya-Uribe LF & Becerril B (2021). The venom of the scorpion Centruroides limpidus, which causes the highest number of stings in Mexico. Mol Immunol 137: 247–255 DOI:10.1016/j.molimm.2021.07.010
Comparte este artículo en redes sociales

Acerca de los autores
El Dr. Baltazar Becerril Luján se doctoró en Ciencias Químicas (Bioquímica) en la Facultad de Química de la UNAM. Actualmente es Investigador Titular “C” y Líder Académico en el Instituto de Biotecnología. Ha generado 92 publicaciones arbitradas con más de 4 mil 100 citas, 8 capítulos de libros y cuenta con 14 patentes otorgadas. En 2010 obtuvo el Premio Nacional de la Industria Farmacéutica (CANIFARMA). La Dra. Lidia Riaño Umbarila es Química Farmacéutica de la Universidad Nacional de Colombia y concluyó los posgrados en Ciencias Bioquímicas en el IBt. Actualmente es Investigadora por México - CONACyT adscrita al Departamento del Medicina Molecular y Bioprocesos de IBt. Es coautora en múltiples artículos del grupo y tiene una amplia experiencia en el manejo de todas las técnicas relatadas en este artículo. En 2010 obtuvo el Premio Nacional de la Industria Farmacéutica (CANIFARMA).
Contacto: baltazar.becerril@ibt.unam.mx, lidia.riano@ibt.unam.mx